Dielectrophoresis (ไดอิเลคโตรโฟเลซีส)
ความรู้ ความเข้าใจ และ การประยุกต์ใช้งาน
เรียบเรียงโดย สิทธิศักดิ์ ปุยอ๊อก -= สถาบันวิจัยจุฬาภรณ์ =- http://up.to/thaiDEP
ปัจจุบันความก้าวหน้าทางวิทยาศาสตร์ทำให้เกิดการประดิษฐ์อุปกรณ์ที่มีขนาดเล็กมากจนถึงระดับนาโนมิเตอร์ได้
จึงเกิดความสนใจที่จะประดิษฐ์อุปกรณ์ที่สามารถนำมาใช้ศึกษาและวิจัยเกี่ยวกับอนุภาคทางชีววิทยาในระดับเซลล์หรือโมเลกุลขนาดใหญ่เช่นโปรตีน
หรือดีเอ็นเอ
โดยที่ได้มีการประยุกต์ใช้ความรู้ทางไฟฟ้าจลน์และความรู้ทางชีววิทยาในระดับเซลล์ผนวกเข้ากับอุปกรณ์ขนาดเล็กเกิดเป็นห้องทดลองในระดับเซลล์ที่สามารถเฝ้ามองและติดตามการเปลี่ยนแปลงของเซลล์
หรือการแบ่งแยกชนิดของเซลล์ได้ทันที
ดังนั้นความรู้และความเข้าใจดังกล่าวจะเป็นประโยชน์อย่างมากต่อการแพทย์และชีววิทยาในการที่จะช่วยย่นระยะเวลาในการวินิจฉัยโรค
และเนื่องจากอุปกรณ์มีขนาดเล็กจึงสามารถที่จะนำไปใช้ในที่ต่างๆได้อย่างสะดวกสบาย
ไดอิเลคโตรโฟเลซีสได้เริ่มเข้ามามีบทบาทเพื่อตอบสนองต่อการใช้งานที่สะดวกและรวดเร็ว
ประหยัดพื้นที่ โดยได้มีการใช้งานอย่างแพร่คลอบคลุมในหลายด้าน เช่น การแพทย์,
พิษวิทยา, จุลชีววิทยา, อุตสาหกรรมอาหาร,
เทคโนโลยีชีวภาพ เป็นต้น [2,3, 8-20] ดังนั้นแล้วเราก็น่าจะเริ่มให้ความสนใจ
หาความรู้ในด้านนี้กันมากขึ้นโดยเฉพาะในประเทศไทย
จุดเริ่มต้นของความสนใจนี้ต้องย้อนกลับไปในปีคศ.1978
เมื่อนักวิทยาศาสตร์ชื่อ Herbert Ackland Pohl ได้แต่งหนังสือชื่อ
Dielectrophoresis the behavior of neutral matter in nonuniform electric
fields1 บรรยายถึงความหมายและอธิบายถึงการเกิดปรากฏการณ์ไดอิเลคโตรโฟเลซีส
เนื้อหาภายในหนังสือได้ให้นิยามของคำว่าไดอิเลคโตรโฟเลซีสไว้ดังนี้
ไดอิเลคโตรโฟเลซีสเป็นการเคลื่อนที่ในแนวขนาน (translational motion) ของอนุภาคที่เป็นกลาง
(neutral matter) ในสนามไฟฟ้าที่ไม่สม่ำเสมอ (nonuniform
electric field) โดยมีสาเหตุจากปรากฏการณ์โพลาไรเซชั่น (polarization) ของอนุภาคนั้นๆ
รูปที่ 1 จะช่วยอธิบายเพื่อให้เกิดความเข้าใจได้ดีขึ้น
จากรูปจะเห็นว่าอนุภาคทรงกลมที่เป็นกลาง(มีประจุบวกและลบจำนวนเท่ากัน)วางไว้ในตัวกลางเช่นสารละลายน้ำตาลเมื่อปล่อยกระแสไฟฟ้าลงไปในสารละลายนั้นอนุภาคดังกล่าวก็จะมีการเรียงตัวของประจุที่ผิวเกิดเป็นขั้วบวกและลบขึ้น
จะสังเกตุเห็นว่าสนามไฟฟ้าที่ถูกปล่อยออกไปนั้นไม่สม่ำเสมอเนื่องจากที่ขั้วบวกจะมีความเข้มของสนามไฟฟ้าที่มากกว่าบริเวณขั้วลบ
หัวใจสำคัญของปรากฏการณ์ไดอิเลคโตรโฟเลซีสกับการประยุกต์ใช้งานก็คือการควบคุมการเคลื่อนที่ของอนุภาคทรงกลมภายใต้สนามไฟฟ้าด้วยการเปลี่ยนแปลงความเข้มข้นของสนามไฟฟ้าดังที่แสดงในรูปที่1
อนุภาคทรงกลมจะเคลื่อนที่ไปทางขั้วบวก โดยปรกติแล้วอนุภาคทรงกลมแต่ละชนิดจะมีคุณสมบัติทางไดอิเลคโตรโฟเลซีสเฉพาะตัวซึ่งเราสามารถนำมาประยุกต์ใช้ในการคัดแยกหรือศึกษาการเปลี่ยนแปลงสภาพของผิวอนุภาคทรงกลม
โดยอาศัยการเคลื่อนที่ที่ต่างทิศทางหรือความเร็วในการเคลื่อนที่ที่ต่างกันของอนุภาคทรงกลมแต่ละตัวเช่นนำมาประยุกต์ใช้ในการแยกแยะเซลล์แบคทีเรียเป็นและเซลล์ตาย2หรือแม้แต่อนุภาคที่มีขนาดเล็กมากเช่นไวรัส,
โปรตีนและดีเอ็นเอ3
เพื่อความเข้าใจมากขึ้นในการศึกษาปรากฏการณ์ไดอิเลคโตรโฟเลซีส
ผู้เขียนจะขอกล่าวถึงกลไกในการเกิดการเคลื่อนที่ของอนุภาคทรงกลมโดยอาศัยความรู้ทางด้านฟิสิกส์ช่วยในการอธิบาย
การเคลื่อนที่ของอนุภาคทรงกลมเกิดขึ้นเนื่องจากแรงไดอิเลคโตรโฟเลซีสซึ่งสามารถอธิบายได้ด้วยสมการ1
FDEP =
(volume)·(polarisability)·(local field)·(field gradient)
เมื่อ FDEP คือแรงที่เกิดจากไดอิเลคโตรโฟเลซีส,
volume คือปริมาตรของอนุภาคทรงกลม, polarisability คือความสามารถที่ทำให้เกิดการจัดเรียงตัวของประจุลบและบวก,
local field คือสนามไฟฟ้าใช้ได้ทั้งกระแสตรงและกระแสสลับ, field
gradient คือสภาพของสนามไฟฟ้าที่ไม่สม่ำเสมอ
เนื่องจากความสลับสับซ้อนเชิงคณิตศาสตร์ซึ่งค่อนข้างยากที่จะเข้าใจได้ในเวลาอันสั้น
ผู้เขียนจึงขอสรุปเป็นความสัมพันธ์ได้ดังสมการต่อไปนี้
FDEP = 2pr3em{Re[K(w)]}ÑE2
กำหนดให้ r คือรัศมีของอนุภาคทรงกลม,
em
คือdielectric permittivity
(อัตราความจุกระแสไฟฟ้า)ของตัวกลาง, Re[K(w)] คือClausius-Mossoti
function เป็นตัวกำหนดค่า polarizabilityของอนุภาคทรงกลมและขึ้นอยู่กับการเปลี่ยนแปลงความถี่ของสนามไฟฟ้า,
ÑE2
เป็นสัดส่วนโดยตรงต่อความแรงและความไม่สม่ำเสมอของสนามไฟฟ้า
สิ่งที่น่าสนใจที่ได้จาก Re[K(w)]
ก็คือเราสามารถควบคุมการเคลื่อนที่ของอนุภาคทรงกลมได้โดยอาศัยการเปลี่ยนแปลงความถี่ของสนามไฟฟ้า
ตามทฤษฎีแล้ว Re[K(w)] จะมีค่าอยู่ระหว่าง +1.0 ถึง 0.5
เมื่อใดที่ Re[K(w)]
มีค่าเป็นบวกจะทำให้ได้ไดอิเลคโตรโฟเลซีสชนิดบวก
และในทางกลับกันถ้าได้ค่าที่เป็นลบแล้วจะเกิดปรากฏการณ์ไดอิเลคโตรโฟเลซีสชนิดลบอย่างที่แสดงไว้ในรูปที่
2 และอีกหนึ่งความจริงก็คือจาก ÑE2 ไม่ว่าเราจะกลับขั้วของสนามไฟฟ้าอย่างไรก็ยังคงได้การเคลื่อนที่ของอนุภาคทรงกลมตามสภาพของสนามไฟฟ้าอย่างที่แสดงไว้ในรูปที่3
ด้วยเหตุนี้ไฟฟ้ากระแสสลับ (AC) หรือกระแสตรง (DC) ก็สามารถนำมาใช้ควบคุมการเคลื่อนที่ของอนุภาคทรงกลมได้
จากรูปที่ 2 จะเห็นได้ว่าเราสามารถควบคุมการเคลื่อนที่ของอนุภาคทรงกลมที่วางอยู่ในตัวกลางที่เป็นของเหลวภายใต้สนามไฟฟ้าได้โดยการปรับเปลี่ยนตัวแปรบางตัวเช่น
1.
ขนาดของอนุภาคทรงกลม
ถ้าอนุภาคทรงกลมมีขนาดที่ต่างกันแต่อยู่รวมกันเมื่อวางอยู่ในสนามไฟฟ้าและตัวกลางเดียวกันย่อมเกิดแรงไดอิเลคโตรโฟเลซีสที่ต่างกัน
2.
การเพิ่มหรือลด dielectric permittivity ของตัวกลางที่อนุภาคทรงกลมถูกวางไว้จะเป็นผลให้แรงไดอิเลคโตรโฟเลซีสเปลี่ยนแปลงไปด้วย
3.
ขนาดและเครื่องหมาย(บวกหรือลบ)จาก K(w) จะส่งผลต่อความแรงและทิศทางของแรงไดอิเลคโตรโฟเลซีส
4.
การเปลี่ยนแปลงความเข้มของสนามไฟฟ้าที่ไม่สม่ำเสมอย่อมมีผลต่อการเกิดแรงไดอิเลคโตรโฟเลซีส
เมื่ออ่านมาถึงตรงนี้แล้วบางท่านอาจจะนึกถึงการเคลื่อนที่ในลักษณะ
อิเลคโตรโฟเลซีส (electrophoresis) ที่มักพบในงานแยกดีเอ็นเอโดยอาศัย
gel electrophoresis ในความเป็นจริงแล้วทั้งสองลักษณะมีความแตกต่างกันอย่างสิ้นเชิงโดยที่การเคลื่อนที่ของอนุภาคทรงกลมภายใต้ปรากฏการณ์อิเลคโตรโฟเลซีสจะขึ้นอยู่กับขั้วของสนามไฟฟ้าและต้องเป็นอนุภาคที่มีประจุ
ผู้อ่านสามารถศึกษาเพิ่มเติมได้จากตารางที่1ประกอบกับรูปที่3
เซลล์กับปรากฏการณ์ไดอิเลคโตรโฟเลซีส
ในสภาพเซลล์ปกติสารอาหารและโมเลกุลภายนอกเซลล์จะเคลื่อนที่ผ่านเข้าออกเซลล์ได้โดยการควบคุมของเยื้อหุ้มเซลล์(cell
permeability) โดยที่สภาพการนำไฟฟ้า(conductance)ของเยื้อหุ้มเซลล์จะต่ำและมีค่าความจุไฟฟ้า(capacitance)ของเยื้อหุ้มเซลล์สูงเกิดเป็นไดอิเลคโตรโฟเลซีสชนิดลบ
เมื่อวางเซลล์ภายใต้สนามไฟฟ้ามันจะเคลื่อนที่ออกห่างจากขั้วไฟฟ้าที่มีความเข้มสนามไฟฟ้าสูง(รูปที่
2a)
แต่เมื่อองค์ประกอบของเยื้อหุ้มเซลล์เปลี่ยนไปอันเนื่องมาจากสารพิษซึ่งจะนำไปสู่การตายของเซลล์หรือapoptosis
(ข้อมูลเพิ่มเติมอ่านได้จาก LAB.TODAY ฉบับที่
32 เดือน ตุลาคม 2548) ความสามารถในการเลือกผ่านของเยื้อหุ้มเซลล์ลดลงโมเลกุลและไอออนต่างๆสามารถเคลื่อนที่เข้าสู่เซลล์ได้มากขึ้นเกิดสภาพนำไฟฟ้าได้ดีขึ้น
เป็นผลให้เซลล์เคลื่อนที่เข้าหาขั้วไฟฟ้าที่มีความเข้มสนามไฟฟ้าสูง(ไดอิเลคโตรโฟเลซีสชนิดบวก)
ความแตกต่างที่เกิดขึ้นนี้ได้ถูกนำใช้ในการคัดแยกระหว่างเซลล์ปกติกับเซลล์ผิดปกติเพื่อช่วยในการวินิจฉัยโรคเช่นการติดเชื้อของเม็ดเลือดแดงจากมาลาเรีย11
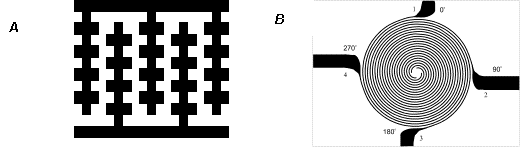
รูปร่างลักษณะของการจัดวางขั้วไฟฟ้า (electrode)
ในการจัดทำขั้วไฟฟ้าเพื่อการศึกษาวิจัยทางด้านไดอิเลคโตรโฟเลซีสนั้นส่วนมากจะทำจากทองคำให้เป็นรูปร่างต่างๆ
(ตามที่แสดงไว้ในรูปที่ 6 และ 7)
แล้วจัดวางขั้วไฟฟ้าลงบนแผ่นกระจกให้อยู่ในระนาบเดียวกัน
ส่วนใหญ่แล้วการจัดวางขั้วไฟฟ้าแบบ quadrupole (ขั้วทั้งสี่วางหันหน้าเข้าหากันโดยมีช่องว่างตรงกลาง)
เป็นที่นิยมกันเนื่องจากไม่มีความซับซ้อนมากและใช้ได้ทั้งไดอิเลคโตรโฟเลซีสประเภท conventional
และ electrorotation โดยช่องว่างตรงกลางจะมีความเข้มของสนามไฟฟ้าน้อยที่สุดเมื่อเทียบกับบริเวณใกล้ขั้วไฟฟ้า
ส่วนรูปแบบการจัดวางแบบอื่นเช่น interdigitated castellated หรือ
spiral ก็มีผู้ประดิษฐ์และทดลองใช้เช่นในการทดลองของ Goater และคณะ7
หรือ Markx และ Pething8
ลักษณะเครื่องมือและอุปกรณ์สำหรับการศึกษาไดอิเลคโตรโฟเลซีส
เนื่องจากปรากฏการณ์ไดอิเลคโตรโฟเลซีสมักจะถูกใช้ในการคัดแยก,
ควบคุมการเคลื่อนที่ของอนุภาคหรือเซลล์ภายใต้สนามไฟฟ้าฉะนั้นแหล่งจ่ายไฟฟ้าจึงมีความจำเป็นอันดับแรก
แหล่งจ่ายไฟฟ้าที่ใช้อาจเป็นได้ทั้งกระแสตรงที่ปรับเปลี่ยนความต่างศักย์ได้หรือกระแสสลับที่สามารถปรับเปลี่ยนความถี่ได้
อันดับต่อมาจะเป็นขั้วไฟฟ้าซึ่งจะมีหลายรูปแบบดังที่ได้กล่าวไว้แล้วการเลือกใช้ขึ้นอยู่กับประเภทของไดอิเลคโตรโฟเลซีสที่สนใจจะศึกษา
อันดับสุดท้ายเนื่องจากขนาดที่เล็กมากของอนุภาคทรงกลมจึงจำเป็นต้องอาศัยเครื่องมือช่วยเช่นกล้องจุลทรรศน์ชนิดแสงธรรมดาหรือกล้องดิจิตอลพร้อมคอมพิวเตอร์เพื่อการประมวลผล
ตัวอย่างการใช้งานแสดงไว้ในรูปที่ 8
ประเภทของไดอิเลคโตรโฟเลซีส
จะเห็นได้ว่าการเคลื่อนที่ของอนุภาคทรงกลมโดยอาศัยแรงไดอิเลคโตรโฟเลซีสนั้นสามารถเกิดขึ้นได้จากการสร้างสนามไฟฟ้าผ่านขั้วไฟฟ้า
ดังนั้นการจัดเรียงตัวของขั้วไฟฟ้าเองย่อมส่งผลให้เกิดการเคลื่อนที่ในลักษณะที่ต่างกันออกไป
โดยการจัดวางขั้วไฟฟ้าในลักษณะต่างๆกันนี้ทำให้เราแบ่งแยกประเภทของไดอิเลคโตรโฟเลซีสออกได้
3 ประเภทหลักคือ
1. conventional
DEP เป็นไดอิเลคโตรโฟเลซีสแบบดั้งเดิมที่ได้อธิบายไว้แล้วข้างต้นกล่าวคืออนุภาคทรงกลมวางอยู่ในสนามไฟฟ้าระหว่างขั้วไฟฟ้าสองขั้ว
อนุภาคทรงกลมจะเคลื่อนที่เข้าหรือออกจากขั้วที่มีความเข้มของสนามไฟฟ้าสูงเมื่อเราปรับเปลี่ยนความถี่ของกระแสไฟฟ้า
2. electrorotation
(ROT) ไดอิเลคโตรโฟเลซีสแบบหมุนวนเป็นการจัดเรียงตัวใหม่ของขั้วไฟฟ้าโดยเพิ่มขั้วขึ้นมาอีก
2 ขั้ววางล้อมรอบอนุภาคทรงกลมและแต่ละขั้วจัดให้มีเฟสของสนามไฟฟ้าต่างกัน 90
องศาอย่างที่แสดงไว้ในรูปที่ 4
หลังจากจ่ายกระแสไฟฟ้าไปยังขั้วต่างๆแล้วอนุภาคทรงกลมจะหมุนด้วยความเร็วที่ต่างกันขึ้นอยู่กับความถี่ของกระแสไฟฟ้าที่จ่ายออกไป
3. traveling
wave DEP (twDEP) เป็นไดอิเลคโตรโฟเลซีสที่ดัดแปลงมาจากแบบหมุนวนโดยจัดให้มีการเรียงตัวเป็นแนวเส้นตรงดังรูปที่
5 เมื่อวางอนุภาคทรงกลมไว้เหนือขั้วไฟฟ้ามันจะเคลื่อนที่ไปทางขวามือตามการเปลี่ยนแปลงเฟสของกระแสไฟฟ้า
การเคลื่อนที่ของอนุภาคทรงกลมจะขึ้นอยู่กับแรงไดอิเลคโตรโฟเลซีสในสองระนาบคือแรงที่ใช้ยกอนุภาคให้ลอยเหนือขั้วไฟฟ้าและแรงที่ช่วยในการเคลื่อนที่แนวระนาบขนานไปกับขั้วไฟฟ้า
อนุภาคที่มีขนาดต่างกันก็จะถูกผลักให้เคลื่อนที่ไปได้ด้วยระยะทางที่ต่างกัน
จากทฤษฎีที่ผ่านมาอาจจะมองเห็นภาพที่เข้าใจยากอยู่บ้าง
เพื่อทำให้ผู้อ่านเข้าใจได้มากขึ้นลองศึกษาการใช้งานจริงดังที่จะได้กล่าวต่อไป
การประยุกต์ใช้งาน
เราอาจแทนที่อนุภาคทรงกลมที่กล่าวถึงข้างต้นด้วยเซลล์ของสัตว์เลี้ยงลูกด้วยนมเช่นเซลล์เม็ดเลือด,
เซลล์มะเร็งชนิดแขวงลอยเช่นเซลล์ลูคีเมีย (leukemia), ไวรัส,
แบคทีเรีย, โมเลกุลของโปรตีน หรือดีเอ็นเอ
เนื่องจากความแตกต่างทางขนาดและรูปร่าง (ทรงกลมหรือแท่ง) ของเซลล์
รวมทั้งองค์ประกอบของผนังเซลล์หรือเยื้อหุ้มเซลล์ (โปรตีน, คาร์โบไฮเดรต)
และองค์ประกอบภายในเซลล์เช่นRNAและDNA ปัจจัยทั้งหลายเหล่านี้เป็นลักษณะเฉพาะของเซลล์แต่ละชนิดแม้แต่ชนิดเดียวกันแต่อยู่ในสถานะภาพที่ต่างกันและเป็นตัวช่วยให้เกิดการจัดเรียงประจุของเซลล์
(polarization) ได้ต่างกันส่งผลต่อการตอบสนองต่อการเกิดแรงไดอิเลคโตรโฟเลซีสที่เฉพาะตัวเป็นประโยชน์อย่างยิ่งในการคัดแยกเซลล์ที่ต้องการออกจากสิ่งแวดล้อม
Lapizco-Encinas และคณะ2
ได้ศึกษาการใช้ประโยชน์จากไดอิเลคโตรโฟเลซีสกับการคัดแยกเซลล์แบคทีเรีย E.
Coli ที่มีชีวิตออกจากเซลล์ที่ตายแล้วด้วยเครื่องมือที่เรียกว่า electrodeless
dielectrophoresis ผลการทดลองแสดงให้เห็นว่าเซลล์ที่มีชีวิตจะถูกแยกออกจากเซลล์ที่ตายโดยอาศัยความแตกต่างระหว่างค่าการนำไฟฟ้า
(conductivity) ของเยื้อหุ้มเซลล์
นั่นคือเซลล์ที่มีชีวิตอยู่จะมีค่าการนำไฟฟ้าที่ต่ำกว่าเซลล์ที่ตายเป็นผลให้เซลล์ที่มีชีวิตเมื่อวางอยู่ภายใต้สนามไฟฟ้าจะอยู่ในตำแหน่งที่ห่างจากขั้วไฟฟ้า
(ไดอิเลคโตรโฟเลซีสชนิดลบ) มากกว่าเซลล์ตาย
(เป็นไดอิเลคโตรโฟเลซีสชนิดลบที่น้อยกว่า)
ทำให้เห็นเป็นการแยกกลุ่มชนิดของเซลล์ได้ตามรูปที่ 9
การประยุกต์ใช้กับงานทางด้านพิษวิทยาก็มีความเป็นไปได้
เพื่อศึกษาการตอบสนองของแบบจำลองเซลล์ต่อสารพิษในเชิงปริมาณและเวลา Ratanachoo
และคณะ9 ได้ทดลองโดยนำแบบจำลองเซลล์ที่เรียกว่า HL-60 มารับสารพิษสี่ชนิดคือ
พาราควอต (paraquat), สไตรีน ออกไซด์ (SO), N-nitroso-N-methylurea
(NMU) and puromycin แล้วทำการตรวจวัดการเปลี่ยนแปลงทางไดอิเลคโตรโฟเลซีสของเยื้อหุ้มเซลล์ตามปริมาณของสารพิษและเวลาที่แตกต่างกัน
ผลการทดลองได้แสดงให้เห็นชัดว่าเทคนิควิธีไดอิเลคโตรโฟเลซีสเป็นวิธีที่มีความไวต่อการตอบสนองของเซลล์ต่อสารพิษและรวดเร็วมากเมื่อเทียบกับวิธีดั่งเดิม
(viability testing) อาจจะกล่าวได้ว่าเทคนิคไดอิเลคโตรโฟเลซีสเป็นอีกวิธีหนึ่งของการทดสอบความเป็นพิษของสารเคมีโดยไม่ใช้สัตว์ทดลอง
นอกจากนี้ความรู้ทางไดอิเลคโตรโฟเลซีสยังได้ถูกนำไปใช้งานร่วมกับเทคนิควิธี
field-flow fractionation (FFF) เพื่อช่วยคัดแยกเซลล์ที่ต้องการออกจากสิ่งแวดล้อม
ผลที่ได้รับเป็นที่น่าพอใจตามที่ Huang และคณะ10 ได้เสนอไว้ในรายงานการทดลอง
The removal of human breast cancer cells from hematopietic CD34+
stem cells by dielectrophoretic field-flow-fractionation เซลล์มะเร็งซึ่งมีสภาพทางด้านไดอิเลคโตรโฟเลซีสชนิดบวกมากกว่า
CD34+ จะถูกจับไว้ในห้อง FFF ได้นานกว่าเป็นผลให้เซลล์มะเร็งเคลื่อนตัวออกมาช้ากว่าเซลล์
CD34+ เกิดการแยกส่วนกันอย่างชัดเจนดังที่รายงานไว้ว่าความสามารถในการคัดแยกทำได้มากกว่า
99.2%
บทสรุป
ความก้าวหน้าทางนาโนเทคโนโลยีได้นำเรามาสู่ยุคใหม่ของการศึกษาทดลองในระดับเซลล์และโมเลกุลผนวกกับความรู้ความเข้าใจทางไฟฟ้าจลน์เป็นผลให้เราสามารถควบคุมการเคลื่อนที่ของอนุภาคทรงกลมเช่นเซลล์เม็ดเลือดภายใต้สนามไฟฟ้าผ่านปรากฏการณ์ไดอิเลคโตรโฟเลซีส
การเคลื่อนที่ของอนุภาคทรงกลมนี้ถูกควบคุมด้วยการเปลี่ยนแปลงสภาพสนามไฟฟ้าและความถี่ของกระแสไฟฟ้า(กรณีที่ใช้ไฟฟ้ากระแสสลับ)
ความสามารถในการควบคุมการเคลื่อนที่ของอนุภาคทรงกลมได้ถูกนำมาใช้ให้เป็นประโยชน์กับการคัดแยกเซลล์ที่มีชีวิตออกจากเซลล์ตาย
นอกจากนี้ยังนำมาใช้ศึกษาการตอบสนองของเซลล์ต่อสารพิษกับงานด้านพิษวิทยาได้อีกด้วย.
เรียบเรียงโดย
สิทธิศักดิ์ ปุยอ๊อก
mailto:sittisak@cri.or.th
ตารางที่
1: แสดงการเปรียบเทียบพฤติกรรมระหว่างปรากฏการณ์ไดอิเลคโตรโฟเลซีส และอิเลคโตรโฟเลซีส
|
ลักษณะ
|
Electrophoresis
|
Dielectrophoresis
|
|
1. ชนิดของอนุภาคทรงกลม
|
มีประจุ
|
เป็นกลาง(บวก-ลบเท่ากัน)
|
|
2. สนามไฟฟ้า
|
ไม่สม่ำเสมอหรือสม่ำเสมอ
|
ไม่สม่ำเสมอ.
|
|
3. ชนิดของสนามไฟฟ้า
|
กระแสตรง
|
กระแสตรงหรือกระแสสลับ
|
|
4. ทิศทางของการเคลื่อนที่
|
วิ่งเข้าหาขั้วตรงข้ามเสมอ
ถ้าวางอนุภาคไว้ในสนามไฟฟ้ากระแสสลับมันจะไม่เคลื่อนที่
|
วิ่งไปยังขั้วที่มีความเข้มของสนามไฟฟ้ามากเสมอถึงแม้ว่าจะมีสลับขั้วของสนามไฟฟ้า
|
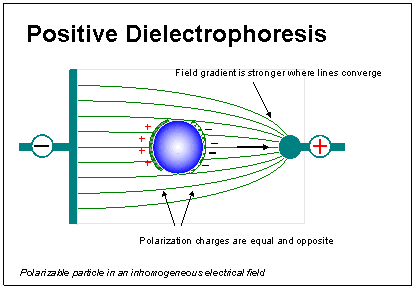
รูปที่
1. ปรากฏการณ์ไดอิเลคโตรโฟเลซีสของอนุภาคในสนามไฟฟ้า (คัดลอกจาก
4)

รูปที่ 2.
ชนิดของปรากฏการณ์ไดอิเลคโตรโฟเลซีส (คัดลอกจาก 5) a) ไดอิเลคโตรโฟเลซีสชนิดลบ
(อนุภาคเคลื่อนที่เข้าหาขั้วบวก) b) ไดอิเลคโตรโฟเลซีสชนิดบวก
(อนุภาคเคลื่อนที่เข้าหาขั้วลบ)
ทั้งสองชนิดเกิดจากสนามไฟฟ้าที่ไม่สม่ำเสมอแต่สิ่งที่ต่างกันคืออนุภาคทรงกลมในรูป a
เกิด polarization น้อยกว่าค่า polarization
ของตัวกลางส่วนในรูป b นั้นอนุภาคทรงกลมกลับมีค่า
polarization ที่มากกว่า polarization ของตัวกลาง
สำหรับท่านที่สนใจชมภาพวีดิทัศน์แสดงการเคลื่อนที่ทั้งชนิดลบและบวกสามารถรับชมได้ที่เวปไซต์
http://www.dielectrophoresis.org/PagesMain/DEP.htm

รูปที่
3
การเปรียบเทียบพฤติกรรมของอนุภาคทรงกลมที่เป็นกลาง(ขนาดใหญ่)กับอนุภาคที่มีประจุ(ขนาดเล็ก)วางอยู่ในสนามไฟฟ้าที่ไม่สม่ำเสมอจะเห็นว่าไม่ว่าจะกลับขั้วของสนามไฟฟ้าอย่างไรอนุภาคทรงกลมที่เป็นกลางจะเคลื่อนที่ไปทางซ้ายเสมอในขณะที่อนุภาคที่มีประจุจะเคลื่อนที่ตามขั้วสนามไฟฟ้า
(คัดลอกจาก 1).
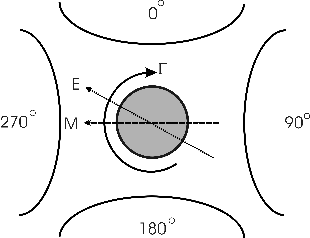
รูปที่ 4 ภาพแสดงการจัดเรียงขั้วไฟฟ้าแบบ electrorotation (คัดลอกจาก
6).
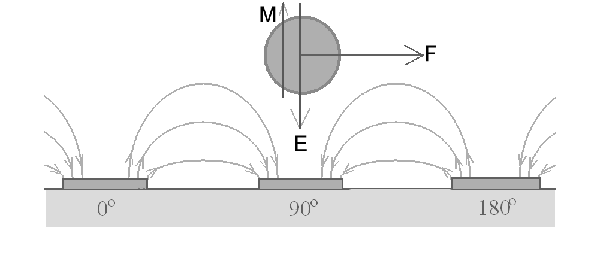
รูปที่
5 ภาพแสดงการจัดเรียงขั้วไฟฟ้าแบบ traveling wave DEP (คัดลอกจาก
6).
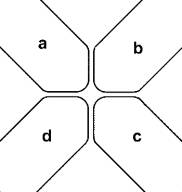
รูปที่
6 ลักษณะการจัดวางขั้วไฟฟ้าแบบ quadrupole.
รูปที่
7 ลักษณะการจัดวางขั้วไฟฟ้าแบบ A) interdigitated castellated และ
B) spiral microelectrode (คัดลอกจาก 7).
รูปที่
8 ภาพแสดงเครื่องมือสำหรับการทดลองไดอิเลคโตรโฟเลซีส.

รูปที่
9 แสดงการใช้ไดอิเลคโตรโฟเลซีสในการแยกเซลล์ E. Coli ที่มีชีวิต
(สีเขียว) ออกจากเซลล์ตาย (สีแดง) โดยเรียงลำดับจากซ้าย(a)เซลล์ภายใต้สภาวะสนามไฟฟ้าต่ำถึงสูง(c)
(คัดลอกจาก 2).
เอกสารอ้างอิง
1. Pohl,
H.A. (1978). Dielectrophoresis the
behavior of neutral matter in nonuniform electric fields. Cambridge
University Press. Cambridge.
2. Lapizco-Encinas,
B.H., Simmons, B.A., Cummings, E.B. and Fintschenko, Y. (2004).
Dielectrophoretic concentration and separation of live and dead bacteria in an
array of insulators Anal. Chem. 76:1571-1579. Available online: http://www.ca.sandia.gov/chembio/microfluidics/pdfs/DielectroPre.pdf
[Date: May 2, 2005].
3. Kua,
C.H., Lam, Y.C., Yang, C. and Youcef-Toumi, K. (2004). Review of bio-particle
manipulation using dielectrophoresis. Available online: http://dspace.mit.edu/bitstream/1721.1/7464/1/IMST026.pdf
[Date: May 2, 2005].
4. The University of Texas, MD Anderson Cancer Center
(2002). A DEP Primer. Available online: http://www.dielectrophoresis.org/PagesMain/DEP.htm
[Date: May 6, 2005].
5.
Zelena,
J. (2002). Electrokinetics of
microparticles using AC dielectrophoresis. Available online: http://www.ee.upenn.edu/~sunfest/pastProjects/Papers02/JohnZ.pdf
[Date: May 9, 200].
6.
Hughes, M.P. (2003). AC electrokinetics: applications
for nanotechnology. Available online: http://www.foresight.org/Conferences/MNT7/Papers/Hughes/index.html.
[Date: 01, 2003].
7.
Goater, A.D., Burt, J.P.H. and Pethig, R. (1997).
Rapid communication-A combined traveling wave dielectrophoresis and
electrorotation device: applied to the concentration and viability
determination of Cryptosporidium.
J. Phys. D:Appl. Phys. 30, L65-L69.
8.
Markx, G.H. and Pething, R. (1995). Dielectrophoretic
separation of cells: continuous separation. Biotechnol. Bioeng.,
45, 337-343.
9.
Ratanachoo K, Gascoyne PR, Ruchirawat M. (2002). Detection of cellular responses to toxicants by
dielectrophoresis. Biochim
Biophys Acta.;1564(2):449-58.
10.
Huang, Y.,
Yang, J. Wang, X.B., Becker, F.F. and Gascoyne P.R.C. (1999). The
removal of human breast cancer cells from hematopietic CD34+ stem
cells by dielectrophoretic field-flow-fractionation. Journal of
Hematotherapy & Stem Cell research. 8, 481-490.
11.
Gascoyne, P.R.C,
Pethig, R., Satayavivad, J., Becker, F.F., Ruchirawat, M. (1997).
Dielectrophoretic detection of changes in erythrocyte membranes following
malarial infection. Biochimica Et Biophysica Acta,
1323:240-252.
12. Kua, C.H., Lam, Y.C., Yang, C. and Youcef-Toumi, K.
(2005). Review of bio-particle manipulation using dielectrophoresis.
Available online: https://dspace.mit.edu/bitstream/1721.1/7464/1/IMST026.pdf.
13. Wang, Z., Hansen, O., Peterson, P.K., Rogeberg, A.,
Kutter, J.P., Bang, D.D. and Wolff, A. (2006). Dielectrophoresis microsystem
with integrated flow cytometers for on-line monitoring of sorting efficiency. Electrophoresis,
27, 5081-5092.
14. Dalton, C., Goater, A.D., Burt, J.P.H.and Smith, H.V.
(2004). Analysis of parasites by electrorotation. J. Appl. Micorbiol.
96, 24-32.
15. Gascoyne, P., Satayavivad, J. and Ruchirawat, M.
(2004). Microfluidic approaches to malaria detection. Acta Tropica,
89, 357-369.
16. Gascoyne, P and Vykoukal, J. (2002). Particle
separation by dielectrophoresis. Electrophoresis, 23, 1973-1983.
17. Green, N.G. and Morgan, H. (1997). Dielectrophoretic
separation of nano-particles. J. Phys. D: Appl. Phys., 30, L41-L44.
18. Goater, A.D., Burt, J.P.H. and Pething, R. (1997). A
combined traveling wave dielectrophoresis and electrorotation device: applied
to the concentration and viability determination of Cryptosporidium. J.
Phys. D: Appl. Phys., 30, L65-69.
19. Suehiro, J, Hamada, R., Noutomi, D., Shutou, M. and Hara,
M. (2003). Selective detection of viable bacteria using dielectrophoretic
impedance measurement method. Journal of Electrostatics, 52(2), 157-168.
20. Wang, X. Becker, F.F. and Gascoyne, P.R.C. (2002). Membrane
dielectric changes indicate induced apoptosis in HL-60 cells more sensitively
than surface phosphatidylserine expression or DNA fragmentation. BBA.
1564, 412-420.